“隔空取物”一直以来是人类的梦想,这种科幻超能力现被超声科技实现并可望用于治病救人。近日,中国科学院深圳先进技术研究院郑海荣研究员团队开发出一种相控阵全息声镊操控技术,在生物体及血流中成功实现了对含气囊细菌群的无创精准操控和高效富集,在动物模型中实现了肿瘤靶向治疗应用。相关成果以“In-vivo programmable acoustic manipulation of genetically engineered bacteria”为题发表在《自然》子刊Nature Communications期刊上。该相控阵全息声镊系统基于高密度面阵列换能器产生可调谐三维体声波,通过对空间声场在活体血管内等复杂环境中的时空精准调控,在活体血管内等复杂环境中成功操控了含气囊细菌团簇,使其精准地移动到目标区域并发挥治疗功能,有望为肿瘤的靶向给药和细胞治疗等提供一种理想手段。

文章上线截图
光、声、电、磁等经典物理手段是实现“隔空取物”非接触操控物体的可能途径。光镊操控技术于2018年获诺贝尔物理学奖,在微纳尺度颗粒操控上展示出精准优势,但存在对非透明生物体穿透深度有限的问题;磁镊一般需要磁性颗粒的结合,易导致细胞活性受影响。相较而言,基于高频声波梯度声场设计的声镊技术是一种通过声波与目标物体相互作用产生辐射力以实现非接触操控物体的方法,在非透明生物体系中具有作用力大、穿透性强、操控通量高等独特优势。基于空间体波的相控阵全息声镊具有声场时空动态调控能力且实验架构灵活,是生物体等复杂环境内实现对目标进行靶向操控的理想手段。
郑海荣研究员带领深圳先进院医学成像团队经过十多年声操控技术积累,基于超声辐射力作用原理,利用高密度二维平面阵列和多通道可编程电子系统,结合空间声场调制、超声成像和时间反演算法,提出并构建了可编程相控阵全息声镊理论、技术和仪器体系,为生物体等复杂环境下的精准声操控奠定了基础(如图1)。团队分析了不同声对比系数粒子受到的声辐射力,完成了初步的理论验证;模拟活体组织环境,利用时间反演矫正声波畸变,构建复杂环境中精准声操控的模型;交替发射超声成像与操控脉冲,实现了非透明介质中超声成像实时引导的三维声镊。团队继续在相控阵全息声镊领域深耕,推动了二维高密度超声阵列的微型化,融合显微成像,初步实现了细胞、微生物等的离体三维声操控验证,进一步结合基因编辑等技术,着力推动可编程相控阵全息声镊在各领域的关键应用。这一次,团队推动相控阵全息声镊高精度高通量操控技术取得了生物医学应用的突破,率先实现了在体声操控细菌对于实体肿瘤的靶向治疗(如图2)。
从理论研究层面,研究团队提出了复杂声场环境中声辐射力离散表达与计算理论,解决了复杂声场的任意结构微粒受力量化表征的瓶颈问题,并探究了复杂环境中空间声场作用下操控目标的动力学行为。从工程研发层面,团队成员马腾研究员等通过长期的技术探索与积累,攻克了高密度声镊换能器研发中声场设计和制造工艺等难题,成功研制了二维高密度超声换能器阵列,利用全息元素构建和时间复用的方法,结合多通道高精度时间反演超声激励,实现了强梯度声场生成和复杂声场的时空动态调控。从生物医学应用层面,团队中严飞研究员等利用基因编辑技术,在细菌细胞中产生了亚微米气体囊泡,显著提升细菌的超声敏感性,大幅增强其受到的声辐射力,使得含气囊细菌可以克服流体拉力,驱使它们在焦点区域聚集形成团簇(如图3)。
当工程菌被聚集成团簇后,通过电子控制声束沿着预设可编程的轨迹移动,如在分叉微流腔中的细菌团簇可以选择性地通过分叉口,或者在无边界条件下沿着字母A形进行移动,或同时操控两个团簇沿着矩形路径移动。整个团簇的轨迹与预设路径完美匹配。利用全息声元素构架法,阵列可以产生具有不同拓扑电荷的聚焦涡旋。当预设的拓扑荷数发生变化时,含气囊细菌团簇所显示的涡旋场模式也随之发生变化。由于角动量的存在,团簇可以围绕涡旋中心连续旋转。
生物体组织结构复杂易引起声波畸变,且高速血流的存在也阻碍了血管内的声操控。团队结合相控阵全息声镊与显微成像,构建动物模型,实现了在活体动物水平通过电子控制声束对含气囊工程细菌进行可编程操控。在小鼠尾静脉注射工程菌后,利用小鼠透明背脊皮翼视窗模型进行观察,打开相控阵全息声镊,使得工程菌在声束焦点处聚集。通过对含气囊工程菌和普通大肠杆菌分别在小鼠背部浅表血管中进行了声捕获比较,发现只有含气囊工程菌可以被捕捉在聚焦声束中心,并在血管中形成簇状。进一步,在不同直径的血管也尝试对含气囊工程菌进行了声捕捉。随后,通过电子偏转声束,实现了含气囊工程菌的体内声操控。在声镊操控下,含气囊工程菌不仅可以沿着血管前后移动,还可以选择性地穿过血管分叉。也可以同时操控两个工程菌团簇在同一条血管中,将其彼此靠近或远离。以上研究结果表明,相控阵全息声镊系统操控含气囊细菌团簇的运动可严格按照程序设置进行,展示出优异的时空操控精度,使这些细菌能够逆流或按需流动到活小鼠的预设血管中。
进一步,高通量相控阵全息声镊操控技术可以显著提高肿瘤中工程细菌的聚集效率,并结合细菌的肿瘤杀死活性,明显抑制了肿瘤的生长速度,延长了荷瘤小鼠的生存期(如图4)。
总之,本研究证明了相控阵全息声镊仪器系统可以作为一种活体内非接触精准操控细胞的新工具。以相控阵全息声镊为手段,功能细胞及细胞球为载体,有望在免疫细胞治疗,组织工程,靶向给药等方面具有重大的应用前景。该研究工作得到了科技部重点研发计划项目、国家自然科学基金、中科院和深圳市科创委等科技项目的资助。
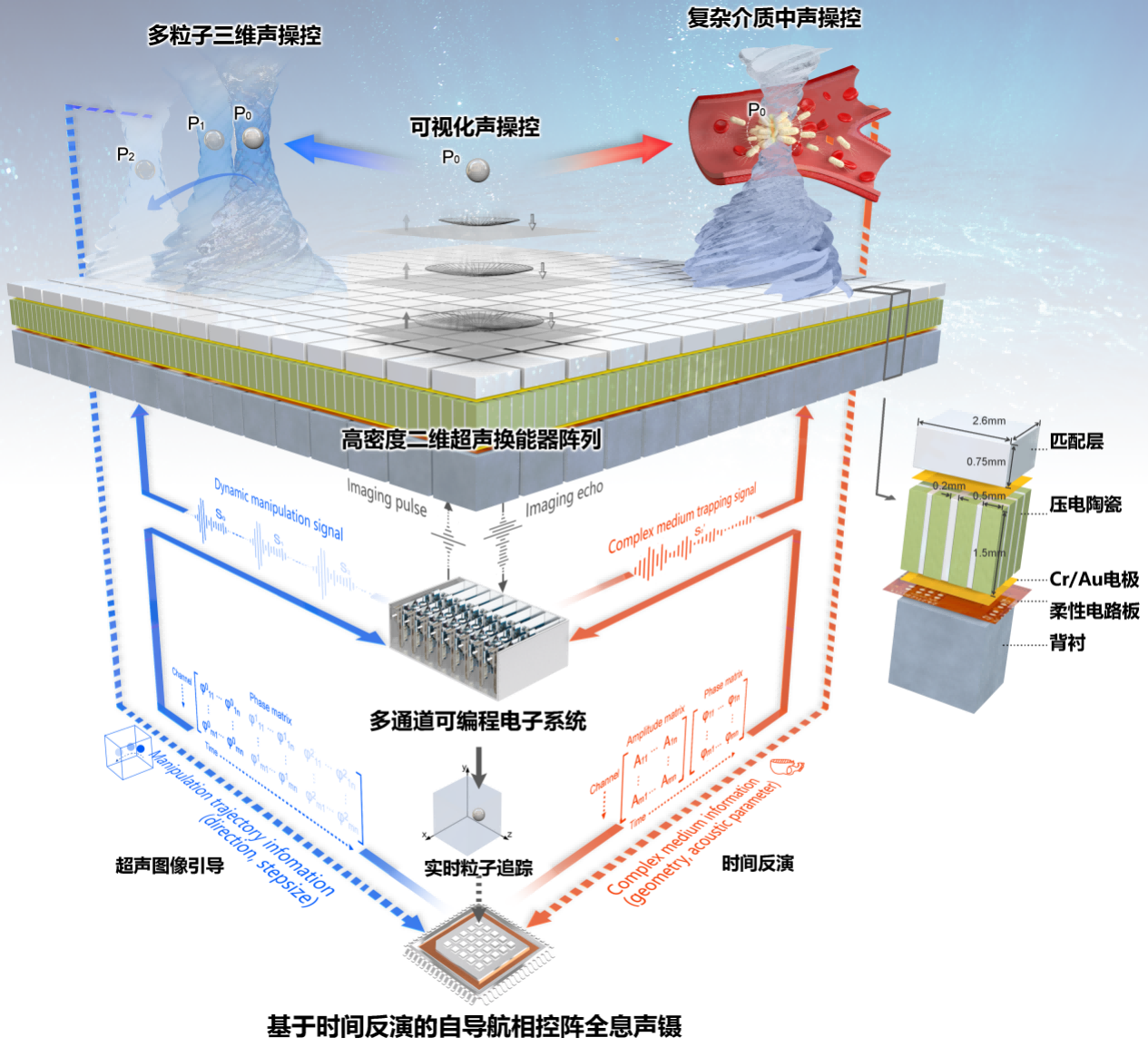
图1 相控阵全息声镊系统示意图(Research,2021)

图2 相控阵全息声镊系统在体操控细胞示意图(Nature Communications,2023)

图3 声聚集基因编辑细菌和普通细菌对比
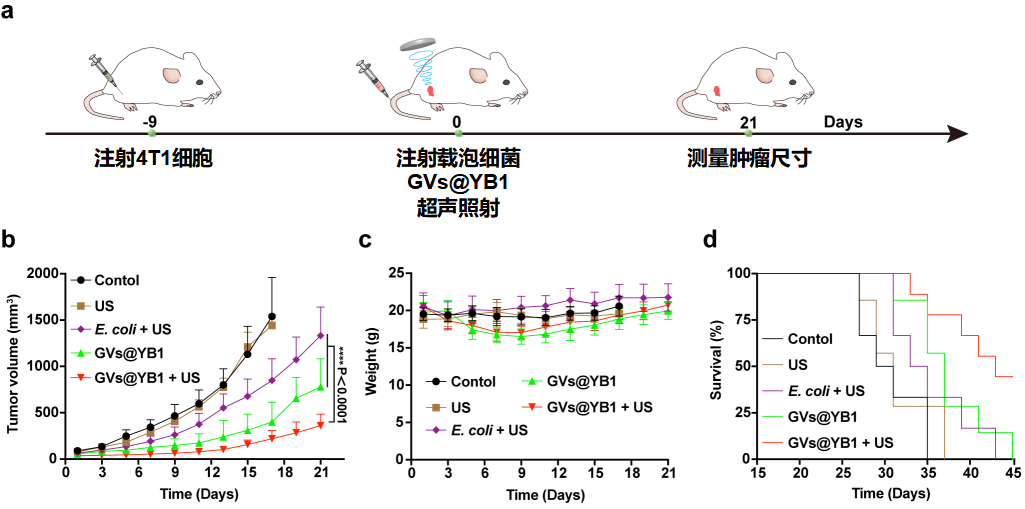
图4 声操控基因编辑细菌治疗肿瘤实验
附件下载:


