人类食用盐有很悠久的历史,从食盐中摄取的钠离子和氯离子在体内扮演着重要的角色;其中氯离子作为细胞内外最大量的阴离子,发挥着多种重要的生理功能,如维持细胞内外的电中性等。氯离子的跨膜转运由多种氯离子转运蛋白家族介导,包括氯离子通道(chloride channel,ClC)、配体门控γ-氨基丁酸和甘氨酸受体、囊性纤维化跨膜电导调节体、阳离子- Clˉ转运体、Clˉ/HCO3ˉ交换体、LRRC8蛋白相关的体积调节阴离子通道等。这些家族成员的氯离子转运蛋白功能一旦发生异常便会导致相应的疾病,如ClC-1功能异常会导致肌强直、ClC-2功能异常会导致脑白质营养不良症和醛固酮增多症、ClC-7功能异常会导致骨骼石化症等。由于氯离子转运蛋白家族间有着极强的结构或功能类似性,只针对一个氯离子转运蛋白作为药物靶点来设计特异性药物的难度不言而喻。
那么,在利用特异性药物治疗由相应转运蛋白功能异常引发的疾病时,如何才能消除或尽可能减少特异性药物脱靶所带来的副作用?
2020年,美国斯坦福大学Anna Koster等研究者通过检测甲氯灭酸的一系列衍生物与ClC-2的结合强度,最终得到与ClC-2特异性结合的衍生物AK-42;其结合ClC-2的强度(IC50 = 17 ± 1 nM)是ClC-1(与ClC-2结构最为相似)1000倍以上。为进一步探究AK-42是如何特异性结合ClC-2并抑制其氯离子转运功能,研究团队通过冷冻电镜确定了apo态的ClC-2和ClC-2/AK-42复合物的高分辨率原子结构,基于结构通过分子动力学模拟确定参与复合物结合界面的关键氨基酸残基,利用点突变和膜片钳技术进一步验证关键氨基酸残基,最终提出特异性抑制剂AK-42堵塞ClC-2机制(如图)。该研究为后续特异性药物设计提供新思路。
深圳先进院助理研究员马涛、南方科技大学博士生王雷、深圳先进院助理研究员柴安平为论文的并列第一作者;深理工药学院讲席教授Horst Vogel、深理工生命健康学院讲席教授王玉田、南方科技大学教授王大平、南方科技大学助理教授闫凯歌、深圳先进院副研究员张华威为论文共同通讯作者。
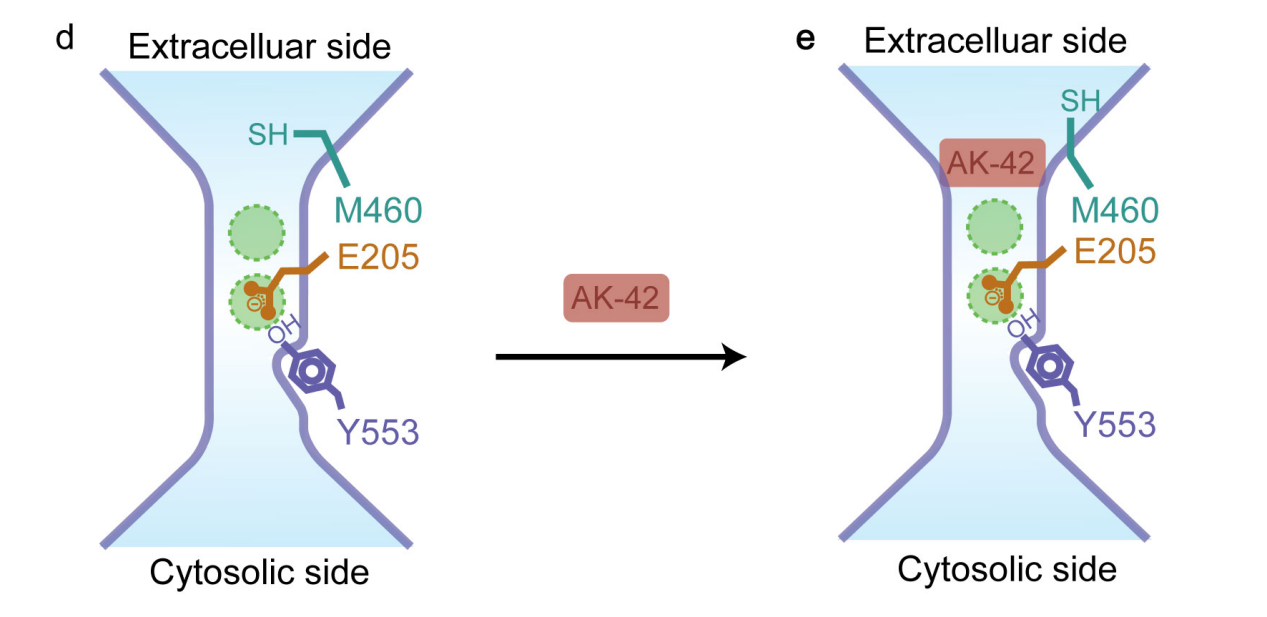
AK-42直接堵塞氯离子通道ClC-2的模型
附件下载:


