中国科学院南海海洋研究所王晓雪研究员团队,2025年9月20日在微生物领域国际权威期刊FEMS Microbiology Reviews发表题为“Post-translational Modifications of the Nucleoid Protein H-NS: Sites,Mechanisms,and Regulatory Cues”的综述论文。该研究系统梳理细菌类组蛋白H-NS的多种翻译后修饰模式,提出这些修饰模式构成“细菌类组蛋白密码”,揭示H-NS通过翻译后修饰驱动细菌基因组进化的精密机制,为理解细菌环境适应、致病机制及开发新型抗菌策略提供重要理论支撑。博士后刘亚博为第一作者,研究员王晓雪为通讯作者。
基因组压缩与动态调控是生命体共通的核心科学问题。细菌缺乏真核生物核小体结构,主要依赖H-NS等核结合蛋白实现基因组的压缩与调控功能。H-NS可沉默原噬菌体、毒力岛等外来基因元件,维持基因组稳定性。研究发现细菌又能在特定环境下解除H-NS的沉默并激活外源基因表达,这一过程是细菌环境适应的关键过程。但细菌宿主如何感应外界环境变化,通过H-NS实现对外来基因元件的精准调控是领域内备受关注的科学问题。
研究整合大肠杆菌、铜绿假单胞菌、希瓦氏菌和杀鱼爱德华氏菌等多物种证据,阐释H-NS通过其N端寡聚化域、中间柔性连接区和C端DNA结合域发生多种翻译后修饰调控其沉默功能:N端修饰调整H-NS聚合状态,掌控基因沉默开关;中间区修饰重塑电荷分布;C端修饰直接改变其对高AT含量DNA的结合能力(图1)。
翻译后修饰是拮抗H-NS沉默的关键机制,与已知的抗沉默蛋白、小分子代谢物及蛋白酶解等途径协同作用,通过感知环境信号、传导调控指令,最终实现表型输出,助力细菌利用外源基因增强环境适应性。尤为重要的是,研究进一步提出,外源基因常编码修饰酶或抗沉默蛋白,在激活条件下解除H-NS介导的基因沉默。这一由外来元件参与的主动“转录解抑制”过程充分呈现了细菌与外来基因元件间的竞争与协作关系,是系统认识微生物中水平基因转移的重要视角。
本研究工作得到国家自然科学基金、国家科技基础资源调查专项、中国博士后科学基金及ONCE等项目的资助。
相关论文信息:Yabo Liu,Xiaoxue Wang*. Post-translational modifications of the nucleoid protein H-NS: sites,mechanisms,and regulatory cues. 2025,FEMS Microbiology Reviews,fuaf045.
论文链接:https://doi.org/10.1093/femsre/fuaf045
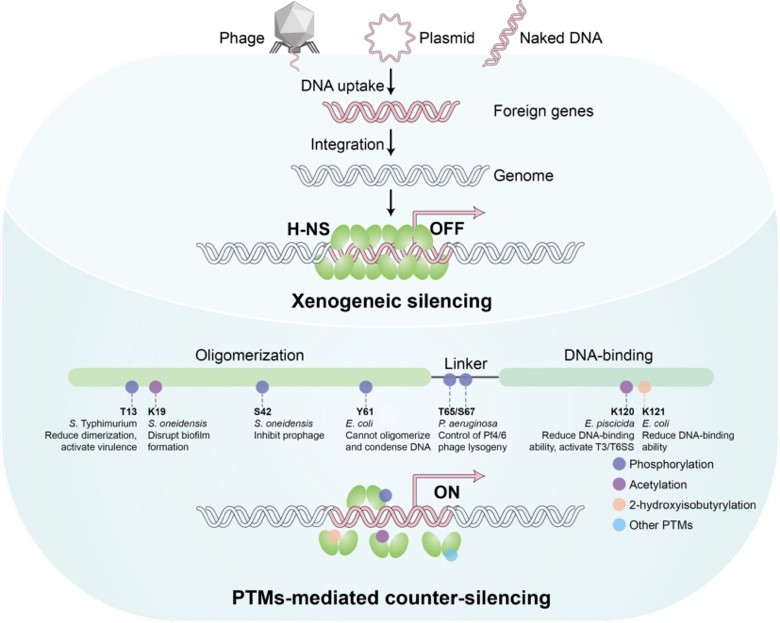
图1 H-NS沉默外源基因表达与翻译后修饰介导抗沉默机制
附件下载:


