近日,中国科学院华南植物园刘勋成团队在植物科学领域著名期刊Molecular Plant(《分子植物》)上发表了题为“HDT2-mediated lysine deacetylation promotes phytochrome A degradation during photomorphogenesis in Arabidopsis”的研究论文。该研究阐明:拟南芥远红光受体——光敏色素phyA的稳定性受乙酰化修饰动态调控,赖氨酸去乙酰化酶HDT2通过介导phyA去乙酰化,促进其泛素化与蛋白降解,从而精确调控远红光信号转导与幼苗光形态建成。该成果不仅深化了对光受体稳定性调控机制的理解,同时揭示了非组蛋白乙酰化修饰在光形态建成中的关键作用。
1、研究背景
光敏色素phyA是植物中唯一特异性感知远红光信号的受体蛋白。在暗生长幼苗中phyA大量累积,而出土照光后迅速发生降解——该过程对于幼苗光信号传递与光形态建成至关重要。然而,phyA稳定性如何被精确调控仍是未解之谜。赖氨酸(K)乙酰化作为进化保守的蛋白质翻译后修饰,既往研究多聚焦于组蛋白调控领域,非组蛋白(如光受体)乙酰化修饰在光形态建成中的作用尚属空白。
2、研究内容
(1)乙酰化组学揭示幼苗从黑暗到照光过程中发生全局去乙酰化事件
研究团队通过Western blot实验发现,幼苗从黑暗转入光照后,整体乙酰化水平显著下降。进一步利用乙酰化组学技术系统鉴定该过程中发生修饰变化的蛋白及位点,发现光诱导了大量的蛋白和位点发生去乙酰化。phyA蛋白上存在4个保守的赖氨酸乙酰化修饰位点(K65,K296,K536和K744),其中K65和K744位点发生显著的去乙酰化(图1)。
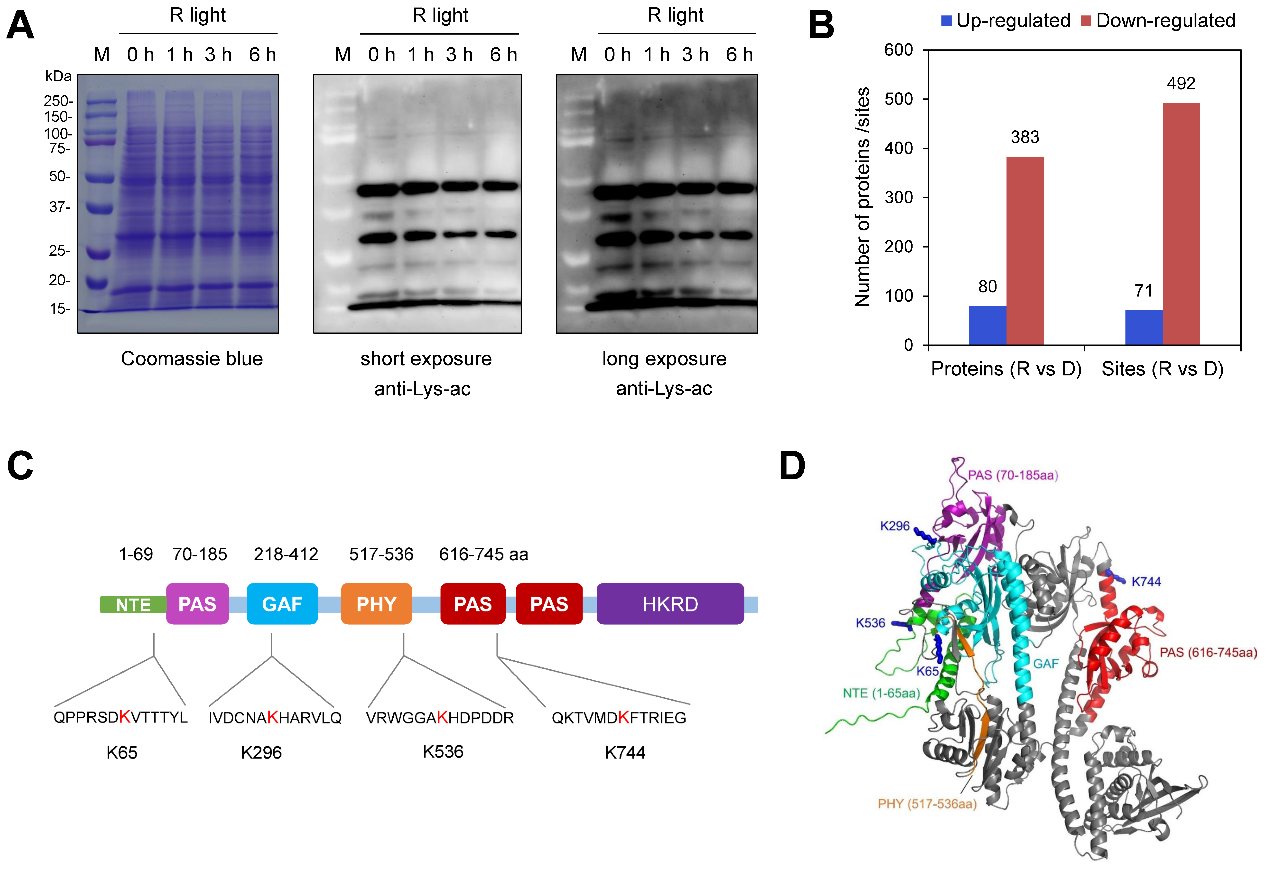
图1. 乙酰化组学分析发现phyA多个赖氨酸位点发生乙酰化修饰
(2)K65位点乙酰化影响phyA稳定性、远红光信号转导以及幼苗光形态建成
通过构建位点特异模拟乙酰化和去乙酰化的转基因回补材料,研究人员证实仅K65位点的乙酰化状态影响了phyA的生物学功能。进一步分析发现,该位点同时也是关键的泛素化修饰位点,其突变显著降低了phyA泛素化水平与降解速率,从而影响了下游转录因子HY5的水平与光响应基因的表达。免疫共沉淀实验表明,光照诱导的K65位点去乙酰化,直接促进了phyA泛素化修饰,进而被26S蛋白酶体途径降解。以上研究首次揭示光诱导的phyA降解需经历“去乙酰化-泛素化”级联反应。
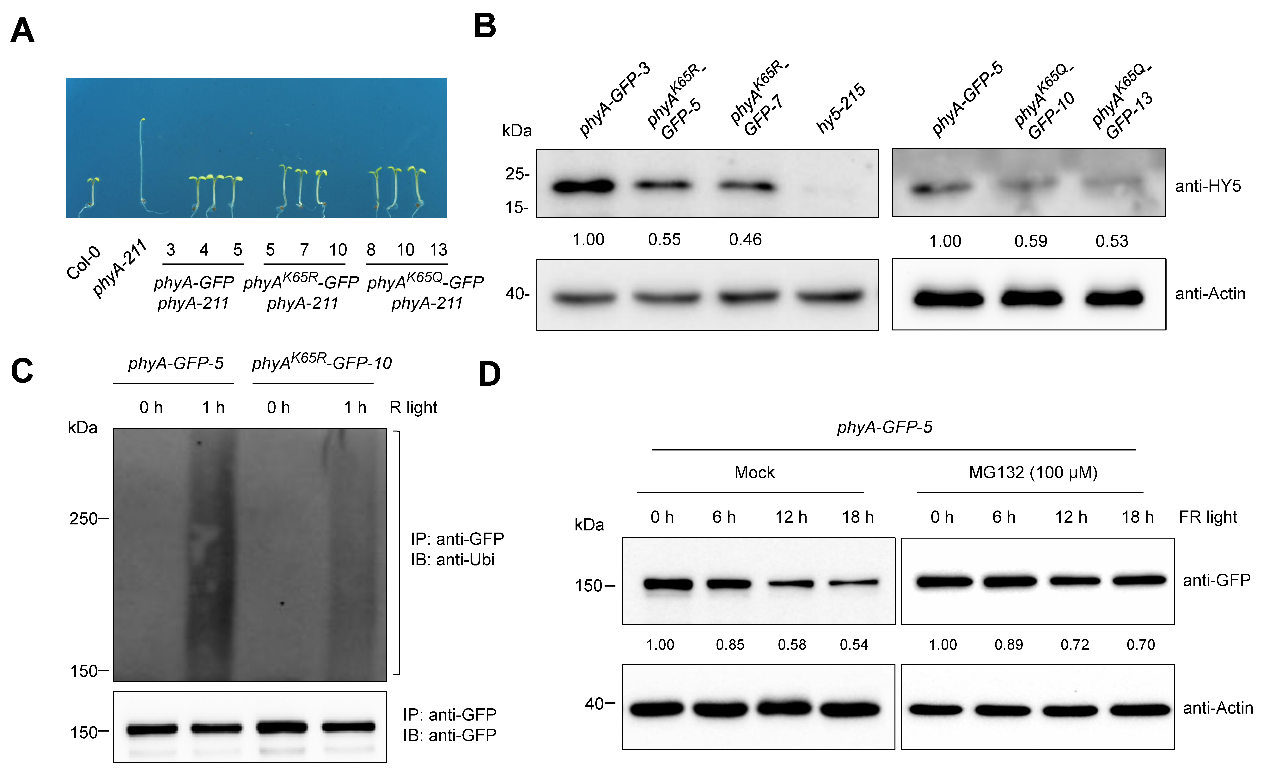
图2. 乙酰化修饰影响phyA的稳定性与生物学功能
(3)赖氨酸去乙酰化酶HDT2介导phyA的去乙酰化
通过蛋白质复合体等互作实验发现,植物特有的赖氨酸去乙酰化酶HDT2在光照后与phyA在细胞核内特异结合。生化分析显示,照光后HDT2催化phyA的K65位点去乙酰化,促进了其泛素化和蛋白降解。超表达HDT2促进而突变HDT2抑制phyA的蛋白降解。遗传证据进一步表明,HDT2特异性参与了phyA介导的远红光信号途径。
综上,研究团队揭示了HDT2-phyA调控模块的核心分子机制:在黑暗条件下,phyA以高乙酰化状态累积;幼苗出土照光后,phyA进入细胞核被HDT2去乙酰化,进而触发泛素化修饰与26S蛋白酶体途径降解。该级联反应精确调控了远红光信号转导与光形态建成。
值得关注是,团队近期在Plant Communications(2025)在线发表了“乙酰化-磷酸化互作”调控向光素phot1激酶活性与植物向光性的研究成果。系列工作表明:乙酰化通过协同泛素化、磷酸化等翻译后修饰,构成植物光信号转导的多维调控网络。
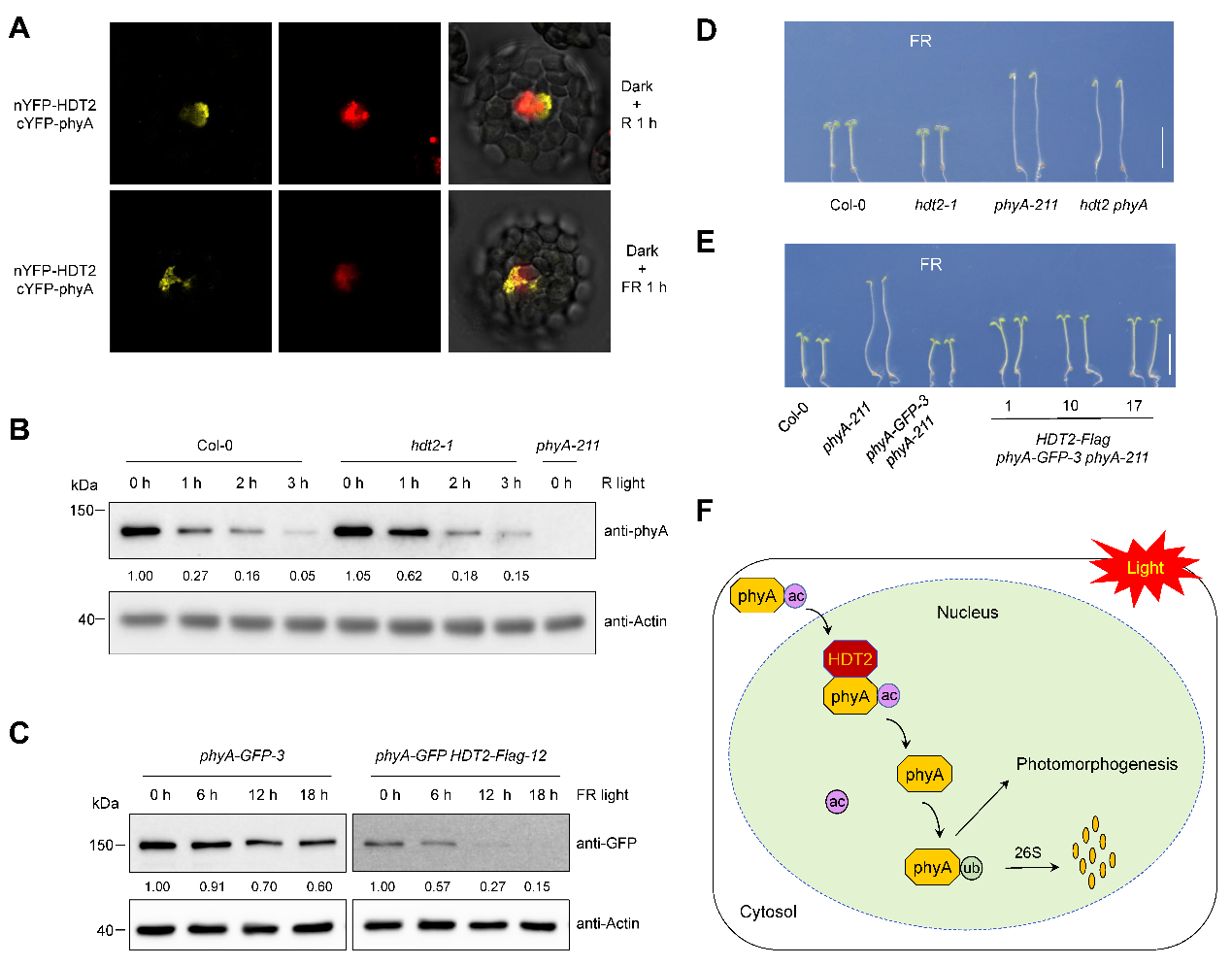
图3. HDT2介导phyA去乙酰化调控远红光信号与光形态建成
3、研究团队
中国科学院华南植物园郑枫助理研究员、硕士研究生欧文立与邓玲为论文的共同第一作者,刘勋成研究员为通讯作者。博士研究生王雅寒与陈航聪,硕士研究生陈依婷、彭滔与杨泳仪,以及国际合作者Jaime A. Teixeira da Silva博士参与了该项研究工作。相关研究得到国家自然科学基金与中国科学院青年创新促进会优秀会员项目资助。
附件下载:


